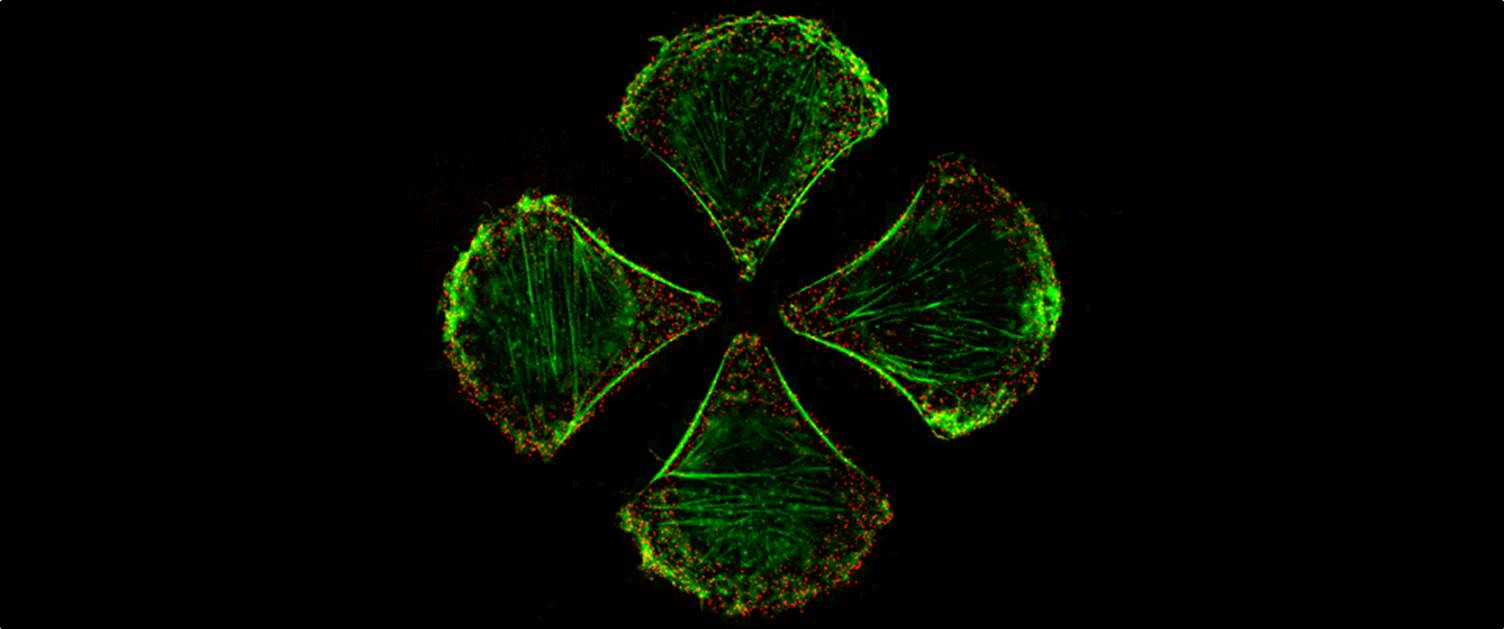
Wenn unter Künsten die schönen Künste verstanden werden, ist für mich Cell micropatterning die Ikone der Kunst in der Zellbiologie schlechthin.
Was versteht man unter Cell micropatterning?
Cell micropatterning steht für eine Vielzahl von verschiedenen Methoden, welche die genaue Kontrolle über die Zellform und Zellpositionierung auf einem Substrat gemeinsam haben. Zum Beispiel ist es möglich, einzelne Zellen in Form eines Kreises, Vierecks, Dreiecks oder gar eins Sterns oder Mondes zu kultivieren.
Um zu verstehen, wie Zellen eine solche Form annehmen können, muss man wissen, dass Zellen in ihrer natürlichen Umgebung, d.h. in vivo von einem komplexen Netzwerk von sezernierten Proteinen und Kohlenhydraten umgeben sind, bestehend z.B. aus Fibronektin, Collagen oder Laminin, zusammengefasst unter dem Begriff extrazelluläre Matrix (EZM). Die extrazelluläre Matrix dient einfach ausgedrückt als Fixierungsmöglichkeit für Zellen. Ferner reguliert die EZM-Zell-Interaktion das Verhalten der Zelle während des Zellwachstums, der Proliferation, der Differenzierung oder der Zellmigration.
Wenn nun die extrazelluläre Matrix als eine Fixierungsmöglichkeit, also als ein Adhäsionsvermittler (banal formuliert als eine Art „Kleber“) dient, bedeutet das, dass sich Zellen auf diesen adhäsiven Regionen ansiedeln können.
Die verschiedenen Methoden zum Cell micropatterning machen sich dieses Konzept zu Nutze, indem sie Substrate für die Zellkultivierung herstellen, auf denen adhäsive und nicht-adhäsive Regionen vorzufinden sind, sodass Zellen nur auf adhäsiven Regionen ansiedeln können. Diese adhäsiven Regionen können zudem in einer bestimmten Geometrie generiert werden und werden als Mikrostrukuren (micropatterns) bezeichnet. Wachsen Zellen auf solchen Mikrostrukturen, können sie je nach Form und Größe der Mikrostrukturen eine annähernd ähnliche Form annehmen.

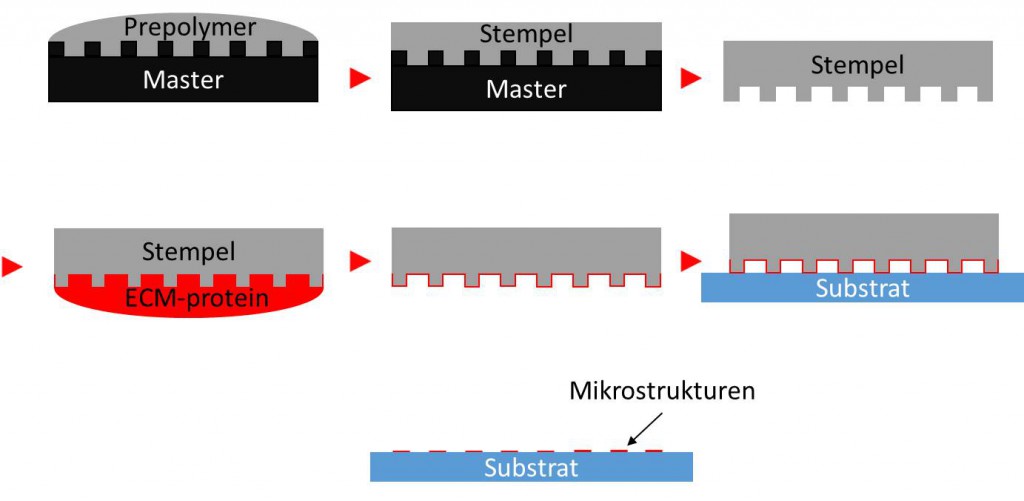
Ein Beispiel zur Herstellung von mikrostrukturierten Substraten:
Eine der am weitesten verbreiteten Methoden zur Herstellung mikrostrukturierter Substrate ist das Mikrokontakt-Drucken (micro-contact printing). Dafür ist ein Stempel von Nöten, der i.d.R. aus einem Polymer wie Silikon hergestellt wird. Dafür wird das Polymer zunächst in flüssiger Form über ein strukturiertes Masterrelief gegossen und ausgehärtet. Während des Aushärtungsprozesses bildet die Topographie der Gussform die strukturierte Oberfläche des zukünftigen Stempels ab. Der fertige Stempel kann dann mit Molekülen wie Fibronektin benetzt werden, ähnlich dem Prinzip einer Tinte bei einem Stempel. Und ähnlich dem Prinzip des Hochdruckverfahrens wird der Stempel mit einem Substrat in Kontakt gebracht und das Fibronektin auf die Substratoberfläche übertragen.
Anwendungen in der Zellbiologie
Das Anwendungsgebiet der Methode ist vielschichtig. Zu den ersten Untersuchungen, welche mikrostrukturierte Substrate in der Zellbiologie benutzten, gehörte die 1997 veröffentlichte Studie „Geometric Control of Cell Life and Death“ von Chen et al. Darin zeigten die Autoren, dass mit der Zunahme der Mikrostrukturengröße die Rate an gestorbenen Zellen abnimmt und gleichzeitig eine Zunahme der DNA Synthese erfolgt. Damit konnten sie nachweisen, dass die Größe der Zellausbreitungsfläche zur Zellteilung und zum Zelltod beiträgt.
Auch die exakte Geometrie der Mikrostrukturen hat einen Einfluss auf das Zellverhalten, insbesondere auf das Zytoskelett. Das Zytoskelett ist ein dynamisches, netzwerkartiges Geflecht aus miteinander verbundenen Proteinen innerhalb der Zelle. Dabei wird zwischen drei verschiedenen Klassen des Zytoskeletts unterschieden.
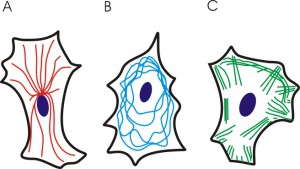
Ähnlich einem Knochenskelett verleiht das Zytoskelett der Zelle seine Form und ist u.a. für die Stabilität und die Fortbewegung der Zelle notwendig. Aber im Vergleich zu einen Knochenskelett ist das Zytoskelett einer Zelle weitaus flexibler. Zum Beispiel muss für die Fortbewegung der Zelle das Netzwerk immer wieder umgestaltet werden. Das wird dadurch erreicht, dass je nach Bedarf Bereiche des Netzwerkes abgebaut und anderswo wieder aufgebaut werden. Je nach Bedingungen der Umgebung der Zelle kann das Zytoskelett eine entspannte oder starre Form annehmen. Dieser Zustand kann unter Umständen Einfluss auf die Differenzierung bzw. auf das Zellschicksal haben. Mit Mikrostrukturen kann auch die Kontraktilität des Zytoskeletts beeinflußt werden.
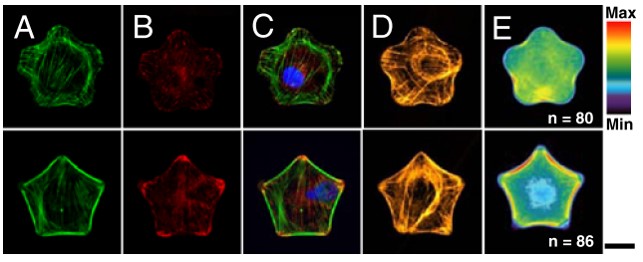
In der Studie von Kilian et al. (2010) wurden humane mesenchymale Stammzellen auf pentagonförmigen und sternförmigen Mikrostrukturen kultiviert. Dabei wiesen die humanen mesenchymalen Stammzellen auf stermförmigen Mikrostrukturen eine erhöhte Actomyosin-Kontraktilität auf und differenzierten eher zu Osteoblasten (knochenbildende Zellen). Unter den gleichen Bedingungen, aber auf pentagonförmigen Mikrostrukturen wiesen die humanen mesenchymalen Stammzellen eine niedrigere Actomyosin-Kontraktilität auf und differenzierten eher zu Adipozyten (Fett-speichernde Zellen).
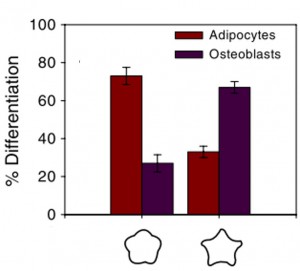
Es ist erstaunlich zu sehen, zu welch unterschiedlichen Zellschicksalen bereits ein so minimaler Unterschied der Form der Mikrostrukturen führen kann. Der einzige Unterschied zwischen den Strukturen liegt darin, dass die eine Struktur eine konkave Wölbung und die andere eine konvexe Wölbung aufweist.
Neben Untersuchungen der Einflüsse der Geometrie von Mikrostrukturen existieren auch rein praktische Gründe, mikrostrukturierte Substrate zu benutzen. Hat man erstmal ein Substrat, auf dem alle kultivierten Zellen gleich aussehen, ergeben sich gleich mehrere Vorteile.

Zunächst einmal ergibt sich aus den gleich aussehenden, gleichverhaltenden Zellen der Vorteil, dass alle Zellen viel leichter zu vergleichen sind als Zellen ohne eine einheitliche Form. Außerdem ergibt sich daraus natürlich auch eine hohe Rate an Reproduzierbarkeit und Verlässlichkeit der Ergebnisse. Möchte man z.B. wissen, wo innerhalb der Zelle sich ein bestimmtes Protein befindet (ob an der Zellgrenze, im Zellkern oder in der Nähe anderer Zellorganellen), könnte eine Untersuchung an Zellen, kultiviert nach klassischen Zellkulturbedingungen, langwierig und schwierig sein. Nach klassischen Zellkulturbedingungen kultivierte Zellen weisen meist keine einheitliche Morphologie auf, sodass die Lokalisation eines bestimmten Proteins und der Vergleich zwischen den Zellen schwer fallen würde und mit großem Aufwand verbunden sein könnte. Weisen die Zellen hingegen alle eine gleiche Morphologie auf, kann eine Aussage über die Lokalisation eines bestimmten Proteins bereits subjektiv schnell vorgenommen werden. Hat man Aufnahmen mehrerer Zellen, auf denen ein bestimmtes Protein markiert ist, kann eine Heatmap erstellt werden, welche die durchschnittliche Verteilung des Proteins aufzeigt.
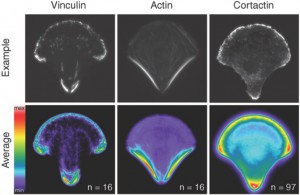
Verfährt man ähnlich bei der Untersuchung weiterer Proteine, kann anschließend eine sogenannte Zellkarte erstellt werden, die die Lokalisation verschiedener zellulärer Bestandteile in einer Graphik zusammenfasst.
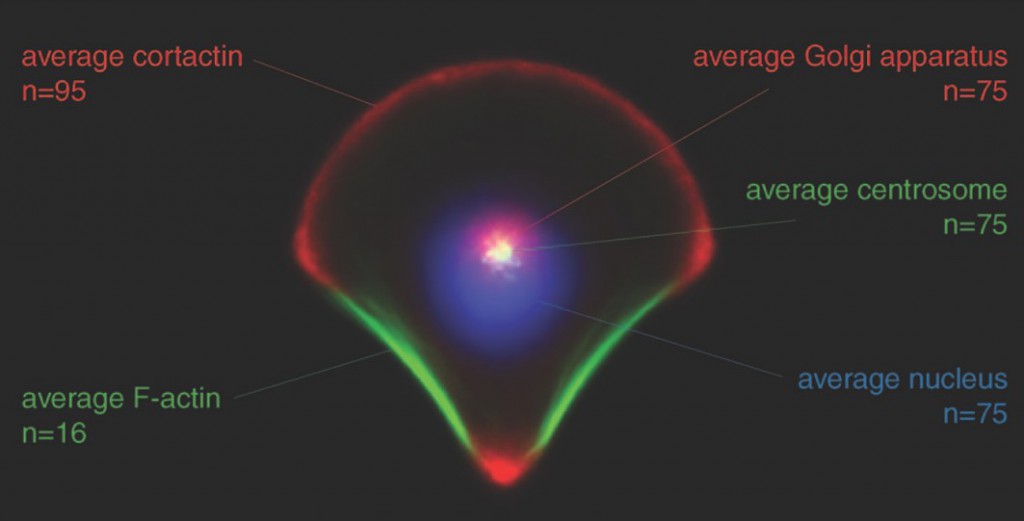
Matthieu Piel, Manuel Théry und seine Kollegen haben dazu eine beeindruckende Sammlung solcher Heatmaps und Zellkarten erstellt, ein Blick in ihren Arbeiten* lohnt sich!
Ein nicht zu vernachlässigender Vorteil ist zudem die Möglichkeit Aufnahmen am Mikroskop zu automatisieren. Da der Abstand der Mikrostrukturen einem definierten Wert entspricht, kann das Mikroskop so programmiert werden, dass es automatisch zu der nächsten Mikrostruktur fährt und die entsprechende Zelle dokumentiert.
Es gibt viele weitere Anwendungsmöglichkeiten, die ich hier leider nicht alle auflisten kann. Zusammen mit Knox habe ich hier ebenfalls einen Artikel zum Thema Cell micropatterning erstellt. Schaut doch mal rein! Immer mehr biologische Labore führen diese Methode für ihre Versuche ein. Falls Ihr noch nicht überzeugt seid, seht selbst, wie Cell micropatterning bereits die Welt erobert hat :D
https://twitter.com/Alexis_Verger/status/606442844090466304
Want to make any kind of cell micropatterns with nothing more than your video-projector? check http://t.co/RO8rWRbw9Z pic.twitter.com/9C4qtzniT9
— THERY Manuel (@ManuelTHERY) March 31, 2014
Hier nur eine kleine Auswahl an Publikationen
-Théry, M., Racine, V., Pépin, A., Piel, M., Chen, Y., Sibarita, J.-B., and Bornens, M. (2005). The extracellular matrix guides the orientation of the cell division axis. Nature Cell Biology 7, 947–953.
-Théry, M., Pépin, A., Dressaire, E., Chen, Y., and Bornens, M. (2006a). Cell distribution of stress fibres in response to the geometry of the adhesive environment. Cell Motility and the Cytoskeleton 63, 341–355.
-Théry, M., Racine, V., Piel, M., Pépin, A., Dimitrov, A., Chen, Y., Sibarita, J.-B., and Bornens, M. (2006b). Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences 103, 19771–19776.
-Tseng, Q., Duchemin-Pelletier, E., Deshiere, A., Balland, M., Guillou, H., Filhol, O., and Thery, M. (2012). Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences 109, 1506–1511.
Literatur
-Grosberg, A., Kuo, P.-L., Guo, C.-L., Geisse, N.A., Bray, M.-A., Adams, W.J., Sheehy, S.P., and Parker, K.K. (2011). Self-Organization of Muscle Cell Structure and Function. PLoS Computational Biology 7, e1001088.
-Grossier, J.-P., Xouri, G., Goud, B., and Schauer, K. (2014). Cell adhesion defines the topology of endocytosis and signaling. The EMBO Journal 33, 35–45.
-Holeček, M., Kochová, P., and Tonar, Z. (2011). Mechanical Properties of Living Cells and Tissues Related to Thermodynamics, Experiments and Quantitative Morphology – A Review, Theoretical Biomechanics, Dr Vaclav Klika (Ed.), ISBN: 978-953-307-851-9, InTech, DOI: 10.5772/19437. Available from: http://www.intechopen.com/books/theoretical-biomechanics/mechanical-properties-of-living-cells-and-tissues-related-to-thermodynamics-experiments-and-quantita
-Kilian, K.A., Bugarija, B., Lahn, B.T., and Mrksich, M. (2010). Geometric cues for directing the differentiation of mesenchymal stem cells. Proceedings of the National Academy of Sciences 107, 4872–4877.
-Théry, M., Racine, V., Piel, M., Pépin, A., Dimitrov, A., Chen, Y., Sibarita, J.-B., and Bornens, M. (2006). Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences 103, 19771–19776.
Beitragsbild: Retinae Pigmentepithelzellen (RPE1) kultiviert auf Anker-förmige Mikrostrukturen. Gefärbt ist das Aktin-Zytoskelett (grün) und das Protein Transferrin (rot). Aus Grossier et al. (2014) veröffentlicht in The EMBO Journal; approved permission request by John Wiley and Sons.